PureTech annonce un nouveau candidat thérapeutique, LYT-310, une forme orale de cannabidiol (CBD) exploitant la plateforme Glyph™ de PureTech
LYT-310 a démontré une augmentation de trois à quatre fois de la biodisponibilité orale du CBD par rapport au CBD non modifié dans un modèle préclinique
Le dosage oral et le potentiel d’amélioration de la tolérance pourraient étendre l’application thérapeutique du CBD à un plus large éventail de groupes d’âge et d’indications, y compris les formes rares et plus courantes d’épilepsie et d’autres troubles du système nerveux central
Preuve supplémentaire de la capacité de la plateforme Glyph à permettre l’administration orale de certaines petites molécules avec une biodisponibilité orale par ailleurs limitée
BOSTON, 30 novembre 2022–(BUSINESS WIRE)–PureTech Health plc (Nasdaq : PRTC, LSE : PRTC) (« PureTech » ou la « Société »), une société biothérapeutique de stade clinique dédiée à changer le paradigme de traitement pour maladies dévastatrices, a annoncé aujourd’hui la nomination d’un nouveau candidat thérapeutique, LYT-310, qui est un promédicament oral du cannabidiol (CBD) et le deuxième candidat thérapeutique développé à partir de la plateforme Glyph™ de PureTech à être avancé vers la clinique. Les études cliniques du LYT-310 devraient commencer au quatrième trimestre de 2023.
Ce communiqué de presse est multimédia. Consultez le communiqué complet ici : https://www.businesswire.com/news/home/20221130005402/en/
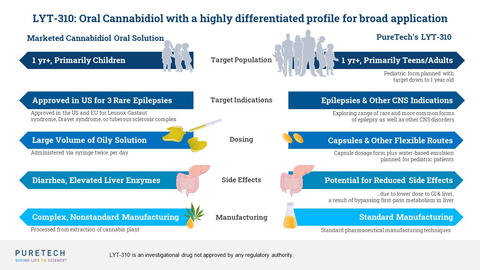
PureTech a annoncé la nomination d’un nouveau candidat thérapeutique, LYT-310, qui est un promédicament oral du cannabidiol (CBD) et le deuxième candidat thérapeutique développé à partir de la plateforme Glyph™ de PureTech à être avancé vers la clinique. L’administration de capsules orales et le potentiel d’amélioration de la tolérance pourraient étendre l’application thérapeutique du CBD à un plus large éventail de groupes d’âge et d’indications, y compris les formes rares et plus courantes d’épilepsie et d’autres troubles du système nerveux central. (Graphique : Business Wire)
Un produit à base de CBD a reçu l’approbation réglementaire aux États-Unis et en Europe pour traiter les convulsions résultant de certaines conditions rares, mais il nécessite un grand volume d’une formulation à base d’huile de sésame, ce qui limite son utilisation dans des indications et des groupes d’âge plus larges. Le LYT-310 de PureTech est conçu pour étendre considérablement l’application thérapeutique et le potentiel du CBD en :
L’histoire continue
permettant l’administration orale dans une capsule ;
étendre l’utilisation du CBD à un large éventail de domaines thérapeutiques et de populations de patients (comme les adolescents et les adultes) où des doses plus élevées sont nécessaires pour obtenir un effet thérapeutique ;
améliorer potentiellement la sécurité et réduire les effets secondaires du tractus gastro-intestinal (GI) associés au traitement à base de CBD actuellement approuvé en réduisant l’exposition gastro-intestinale et hépatique ; et
permettant un produit facilement évolutif et cohérent de manière rentable.
« La nomination du LYT-310 est une expansion passionnante de la technologie Glyph de PureTech », a déclaré Daniel Bonner, Ph.D., vice-président de PureTech Health. « Les données générées à ce jour avec LYT-310 démontrent davantage notre capacité à appliquer la technologie Glyph à un ensemble de molécules pour activer ou améliorer considérablement la biodisponibilité orale. Cette approche nous permet de libérer le potentiel thérapeutique d’une gamme de molécules à l’efficacité validée dont le développement a été limité par le métabolisme de premier passage par le foie. »
Dans plusieurs modèles précliniques, y compris les grands animaux et les primates non humains, LYT-310 a démontré une augmentation de trois à quatre fois de l’exposition orale par rapport au CBD non modifié à jeun. Cela a le potentiel de se traduire par une sécurité améliorée et des effets secondaires réduits. Le transport lymphatique a également été confirmé dans des modèles précliniques, avec jusqu’à 30 % de LYT-310 pénétrant dans les lymphatiques, contre 5 % pour le CBD non modifié – ce qui soutient davantage le nouveau mécanisme Glyph d’amélioration de la biodisponibilité.
Le premier candidat de la plateforme technologique Glyph, LYT-300 (allopregnanolone orale), est actuellement évalué dans le cadre d’un essai de phase 1 en plusieurs parties conçu pour démontrer la biodisponibilité orale, évaluer l’innocuité et la tolérabilité sur une gamme de doses et éclairer la sélection des doses. avancer. Le premier objectif a été atteint plus tôt cette année, et LYT-300 a démontré une biodisponibilité orale de l’allopregnanolone environ neuf fois supérieure à celle de l’allopregnanolone administrée par voie orale, sur la base de données publiées précédemment. L’essai clinique de phase 1 devrait être achevé d’ici la fin de 2022 et, sur la base des données, un essai clinique de phase 1b/2a devrait débuter en 2023.
À propos de la plateforme GlyphTM
Glyph est la plate-forme de chimie synthétique de ciblage lymphatique de PureTech, conçue pour utiliser le processus naturel d’absorption et de transport des lipides du système lymphatique afin de permettre l’administration orale de certains traitements. Glyph lie de manière réversible un médicament à une molécule de graisse alimentaire, créant ainsi un nouveau promédicament. La molécule de graisse liée redirige la voie normale du médicament vers la circulation systémique, contournant le foie et se déplaçant à la place de l’intestin vers les vaisseaux lymphatiques qui traitent normalement les graisses alimentaires. PureTech pense que cette technologie a le potentiel (1) de permettre une modulation directe du système immunitaire via des cibles médicamenteuses présentes dans les ganglions lymphatiques mésentériques et (2) de fournir un moyen largement applicable d’améliorer la biodisponibilité de certains médicaments administrés par voie orale qui seraient autrement limités par métabolisme hépatique de premier passage. PureTech accélère le développement d’un portefeuille Glyph qui tire parti de l’efficacité validée, en donnant la priorité aux médicaments hautement caractérisés pour évaluer la capacité de la technologie Glyph à améliorer la biodisponibilité orale ou le ciblage lymphatique. Le principal candidat thérapeutique Glyph de PureTech, LYT-300 (allopregnanolone oral), est actuellement en cours d’évaluation dans le cadre d’un essai clinique de phase 1 en plusieurs parties qui devrait se terminer d’ici la fin de 2022. Un deuxième candidat thérapeutique, LYT-310 (cannabidiol oral ), devrait entrer dans la clinique au quatrième trimestre de 2023. PureTech dispose d’un solide portefeuille de propriété intellectuelle qui comprend des brevets sous licence ainsi que des brevets en propriété exclusive, couvrant la plate-forme technologique Glyph, qui est basée sur les recherches pionnières de Christopher Porter, Ph. D., et son groupe de recherche à l’Institut Monash des sciences pharmaceutiques de l’Université Monash. Le groupe de recherche Porter et ses collaborateurs ont publié des recherches dans Nature Medicine, Angewandte Chemie et le Journal of Controlled Release soutenant la capacité de la plateforme Glyph à cibler directement le système lymphatique avec une variété de thérapies.
À propos de PureTech Santé
PureTech est une société biothérapeutique dédiée à changer le paradigme du traitement des maladies dévastatrices. La société a créé un pipeline large et profond grâce à l’expertise de son équipe expérimentée de recherche et développement et à son vaste réseau de scientifiques, de cliniciens et de leaders de l’industrie. Ce pipeline, qui progresse à la fois en interne et via les entités fondées de PureTech, comprend 28 produits thérapeutiques et candidats thérapeutiques, dont deux (Plenity® et EndeavorRx®) qui ont reçu à la fois l’autorisation de la FDA américaine et l’autorisation de mise sur le marché européenne et un troisième (KarXT) qui sera bientôt déposée pour approbation par la FDA, à la date de la dernière mise à jour de la Société. Tous les programmes et plateformes sous-jacents qui ont abouti à ce pipeline de candidats thérapeutiques ont été initialement identifiés ou découverts, puis avancés par l’équipe de PureTech à travers des points de validation clés basés sur des connaissances uniques en immunologie et en développement de médicaments.
Pour plus d’informations, visitez www.puretechhealth.com ou connectez-vous avec nous sur Twitter @puretechh.
Mise en garde concernant les déclarations prospectives
Ce communiqué de presse contient des déclarations prospectives au sens de la Private Securities Litigation Reform Act de 1995. Toutes les déclarations contenues dans ce communiqué de presse qui ne se rapportent pas à des faits historiques, y compris, sans s’y limiter, les déclarations relatives au potentiel d’amélioration tolérance associée au LYT-310 par rapport au CBD non modifié, qu’une telle amélioration potentielle de la tolérance et du dosage oral pourrait étendre l’application thérapeutique du CBD à un plus large éventail de groupes d’âge et d’indications, nos attentes concernant la plate-forme technologique Glyph™, y compris le potentiel de nouvelles applications de traitement, l’applicabilité des résultats précliniques aux sujets humains, le calendrier des essais cliniques associés à LYT-300, nos produits candidats et notre approche pour traiter les principales maladies, ainsi que nos perspectives, développements et stratégies futurs. Les déclarations prospectives sont basées sur les attentes actuelles et sont soumises à des risques connus et inconnus, des incertitudes et d’autres facteurs importants qui pourraient faire en sorte que les résultats, performances et réalisations réels diffèrent sensiblement des attentes actuelles, y compris, mais sans s’y limiter, ces risques, les incertitudes et autres facteurs importants décrits sous la rubrique « Facteurs de risque » dans notre rapport annuel sur formulaire 20-F pour l’exercice clos le 31 décembre 2021 déposé auprès de la SEC et dans nos autres documents réglementaires. Ces déclarations prospectives sont basées sur des hypothèses concernant les stratégies commerciales présentes et futures de la Société et l’environnement dans lequel elle opérera à l’avenir. Chaque énoncé prospectif ne vaut qu’à la date du présent communiqué de presse. Sauf si la loi et les exigences réglementaires l’exigent, nous déclinons toute obligation de mettre à jour ou de réviser ces déclarations prospectives, que ce soit à la suite de nouvelles informations, d’événements futurs ou autrement.
Voir la version source sur businesswire.com : https://www.businesswire.com/news/home/20221130005402/en/
Contacts
PureTech
Relations publiques
[email protected]
Relations avec les investisseurs
[email protected]
Médias
Nichole Sarkis
+1 774 278 8273
[email protected]
