Le cannabidiol rend-il le cannabis plus sûr ? Un essai randomisé, en double aveugle et croisé sur le cannabis avec quatre ratios CBD:THC différents
L’étude a été approuvée par le comité d’éthique de la recherche du King’s College de Londres (RESCMR-16/17-4163). Tous les participants ont fourni un consentement éclairé écrit et l’étude a été menée conformément aux principes de bonnes pratiques cliniques, la Déclaration d’Helsinki (1996). L’étude a été enregistrée sur Open Science Framework (https://osf.io/kt3f7) et clinicaltrials.gov (NCT05170217).
Sommaire
Concevoir
Cette étude randomisée, en double aveugle, à quatre bras et intra-sujets a été menée au NIHR Wellcome Trust Clinical Research Facility (CRF) au King’s College Hospital, Londres, Royaume-Uni (randomisation et masquage décrits dans l’annexe pp2). Les participants ont assisté à une session de référence, suivie de quatre visites expérimentales, avec une période de sevrage d’au moins une semaine entre chaque visite expérimentale (la durée moyenne entre les expériences était de 24 jours).
Intervenants
Quarante-six volontaires sains (âgés de 21 à 50 ans), qui avaient consommé du cannabis au moins une fois dans le passé, mais n’avaient pas consommé de cannabis > 1/semaine au cours des 12 derniers mois, n’avaient jamais consommé de cannabinoïdes synthétiques et n’avaient pas toxicomanie ont été recrutés. Des critères d’inclusion/exclusion supplémentaires sont répertoriés dans l’annexe pp2.
Procédure (Fig. 1)
Au départ, les participants ont été évalués pour l’éligibilité à l’étude et ont pratiqué la procédure d’inhalation. Au départ et à toutes les visites expérimentales, un dépistage urinaire de drogue et de grossesse ainsi que des tests respiratoires d’alcool et de monoxyde de carbone (<10 ppm de CO pour vérifier 12 h d'abstinence tabagique) ont été effectués. Il a été demandé aux participants d'éviter de consommer du cannabis et toute autre drogue illicite pendant toute la durée de l'étude, y compris les périodes entre les sessions.
Fig. 1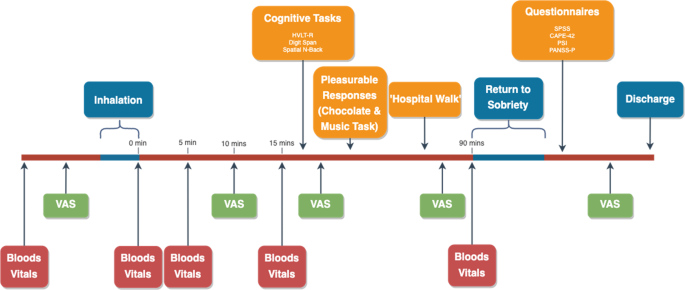
Chronologie des séances de référence et expérimentales (la référence n’incluait pas les prélèvements sanguins ou le retour à la sobriété).
Avant chaque visite expérimentale, les participants avaient leur petit-déjeuner habituel et leur quantité de caféine – la caféine n’était plus autorisée avant la fin des tests cognitifs. Une canule intraveineuse a été insérée avant que les participants ne reçoivent du cannabis vaporisé (détaillé ci-dessous). Quinze minutes après la fin de l’inhalation de cannabis, les participants ont effectué une batterie de tâches cognitives (30 à 35 min). Cela a été suivi d’évaluations des réponses agréables au cannabis ainsi que d’une « marche à l’hôpital » (15 min), une tâche qui s’est déjà avérée augmenter la paranoïa après le THC. [14]. Dans cette tâche, les participants recevaient 2 £ pour acheter un article de leur choix auprès d’un opérateur de caisse dans le magasin de l’hôpital et pour demander un reçu avant de retourner au CRF. L’équipe de recherche a observé à distance pour des raisons de sécurité. Les participants ont ensuite reçu un déjeuner et suffisamment de pause pour permettre à tout effet enivrant de se dissiper. Lorsque les participants ont estimé qu’au moins 90 % de l’effet du médicament s’était atténué, ils ont rempli les questionnaires psychologiques (CAPE, PSI et SSPS, détaillés ci-dessous) et un entretien clinique semi-structuré (PANSS-P, détaillé ci-dessous). Cette approche permet aux échelles de capturer tous les symptômes qui se sont produits tout au long de l’expérience, par opposition à ceux qui sont évidents à un moment donné. Nous avons précédemment constaté que l’évaluation des participants après la fin de la phase maximale d’intoxication aiguë augmente la probabilité qu’ils divulguent des pensées délirantes ou des soupçons. [10, 15]. Les participants ont été libérés après un test de sobriété sur le terrain, après avoir été informés des protocoles de sécurité et ont reçu un numéro d’urgence 24h/24.
Médicament à l’étude et administration
Le médicament à l’étude a été fourni sous forme d’inflorescence de cannabis granulé par Bedrocan BV (Pays-Bas) produit conformément aux bonnes pratiques de fabrication et confirme les niveaux de contaminants de l’Agence européenne des médicaments pour les produits utilisés dans les voies respiratoires. Chaque dose de cannabis consistait en 10 mg de THC (deux unités standard de THC [16]) et soit 0 mg, 10 mg, 20 mg ou 30 mg de CBD. Les participants ont reçu des préparations avec des ratios CBD:THC de 0:1, 1:1, 2:1 et 3:1, dans un ordre aléatoire d’une visite à l’autre. Bedrocan (22,6 % THC, 0,1 % CBD), Bedrolite (7,5 % CBD, 0,3 % THC) et le placebo Bedrocan (<0,01 % THC) ont été utilisés pour fournir du cannabis contenant du THC, du CBD et un placebo, respectivement. Le cannabis placebo a été ajouté pour s'assurer que toutes les préparations avaient le même poids (voir Annexe pp4).
Les préparations de cannabis ont été administrées à l’aide d’un vaporisateur Volcano® Medic (Storz-Bickel GmbH, Tüttlingen, Allemagne). Chaque préparation a été vaporisée à 210°C dans un sac en polyéthylène transparent. Cette température a été trouvée pour maximiser la livraison de cannabinoïdes [17]. Une fois rempli, le sac transparent a été enveloppé d’un sac opaque pour assurer l’aveuglement (un rapport CBD:THC plus élevé produit une vapeur plus dense). L’inhalation a été standardisée en demandant aux participants de retenir leur respiration pendant 8 s avant d’expirer, avec une pause de 8 s entre les inhalations (comme décrit dans [18]). Les participants ont été invités à inhaler une quantité confortable de vapeur à chaque inhalation afin de minimiser le risque de perte du médicament à l’étude par la toux. La procédure s’est poursuivie jusqu’à ce que le contenu de deux sacs ait été vidé – tous les participants ont réussi à inhaler tout le contenu des deux sacs lors de toutes les visites. La durée d’inhalation de chaque visite a été enregistrée et la gravité de la toux des participants a été évaluée par les chercheurs à l’aide d’une échelle visuelle analogique. Une tasse d’eau tiède au citron et au miel a été fournie pour aider à réduire l’abrasivité de l’inhalation de cannabis.
Prélèvement et analyse de sang
Des échantillons de sang veineux ont été prélevés avant l’administration du médicament et à 0, 5, 15 et 90 min après l’expiration finale, ainsi que la pression artérielle, la fréquence cardiaque et la température. La concentration de Δ9-THC, 11-OH-Δ9-THC (OH-THC), 11-COOH-Δ9-THC (COOH-THC), CBD et 7-OH-CBD a été déterminée à l’aide d’une LC/MS haute performance au Installation de spectrométrie de masse, KCL [19].
Tâches cognitives
Tâche d’apprentissage verbal de Hopkins—Révision (HVLT-R) [20]
Un chercheur a lu une liste de 12 mots au participant, qui a ensuite répété la liste. Cela a été répété sur trois essais, le nombre total de mots rappelés indexant le rappel immédiat. 20 à 25 minutes plus tard, les participants ont été invités à rappeler à nouveau les mots, en indexant le rappel différé. Le pourcentage de mots correctement rappelés indexés. Les mots rappelés qui étaient liés aux mots de la liste d’origine, mais qui n’en faisaient pas partie, ont été définis comme des intrusions. Les répétitions font référence au nombre de fois qu’un mot correctement rappelé a été répété. Une liste de mots différente a été utilisée à chaque visite d’étude et l’ordre a été randomisé.
Plage de chiffres avant et arrière
L’étendue des chiffres est une mesure de la mémoire de travail verbale et de l’attention, impliquant le rappel de séquences de nombres de longueur croissante (WAIS-III). Commençant par trois chiffres en avant et deux chiffres en sens inverse, la tâche a cessé lorsque le participant a échoué deux tentatives consécutives à une séquence de nombres.
N-retour spatial [21]
Les participants ont répondu à un stimulus visuel apparaissant dans l’un des huit emplacements, la demande de tâche variant selon les conditions 0-dos, 1-dos et 2-dos. Les participants devaient indiquer (en appuyant sur un bouton Oui ou Non) si le stimulus apparaissait à la position 12 heures (0-back), à la même position que le stimulus visuel précédent (1-back) ou à la même position que le stimulus visuel deux précédents (2-retour).
Mesures psychologiques
Échelle des syndromes positifs et négatifs—sous-échelle positive (PANSS-P) [22]
Le PANSS-P est un entretien semi-structuré évalué par un enquêteur, qui évalue les symptômes psychotiques positifs (délires, désorganisation conceptuelle, hallucinations, hyperactivité, grandiosité, méfiance et hostilité). Les informations de cette évaluation ont été complétées par les observations du chercheur et les interactions avec le participant, alors qu’il était en état d’ébriété.
Échelle de paranoïa sociale de l’État (SSPS) [23]
Le SSPS a été utilisé pour évaluer les pensées de persécution.
Évaluation communautaire des expériences psychiques – état (CAPE-état) [24]
L’état CAPE est une échelle d’auto-évaluation et a été utilisé pour évaluer les expériences de type psychotique.
Inventaire des états psychotomimétiques (PSI) [25]
Le questionnaire PSI a été utilisé pour évaluer les expériences de type psychotique suite à la consommation de cannabis.
Échelles visuelles analogiques (EVA)
Les EVA ont été utilisées pour mesurer les effets subjectifs le long d’un continuum. Les participants ont marqué sur une ligne horizontale de 100 mm pour indiquer le niveau d’un sentiment donné à ce moment (0 mm ‘Pas du tout’ à 100 mm ‘Extrêmement’). Les états émotionnels comprenaient : « ressentir l’effet de la drogue », « effet similaire à celui de la drogue », « vouloir plus de drogue », « déficience mentale », « bouche sèche », « perception sonore améliorée », « perception améliorée des couleurs », « vouloir de la nourriture », « envie d’alcool », « planant », « calme et détendu », « fatigué », « anxieux », « paranoïaque », « défoncé » et « plaisir ». Les VAS ont été administrés 5 fois au cours de la session expérimentale : avant l’administration du médicament, 10 minutes après l’administration du médicament, après l’évaluation cognitive, après la marche à l’hôpital et enfin avant la sortie. Afin d’explorer les effets des médicaments au fil du temps, nous avons inclus des analyses de l’aire sous la courbe (AUC) ainsi que des effets maximaux.
Réponses agréables
Les effets agréables du cannabis ont été évalués par le participant évaluant son plaisir d’un morceau de chocolat au lait (Marabou) ou noir (Lindt 70 %), et d’un morceau de musique choisi par lui-même, sur une échelle visuelle analogique (EVA), allant de −5 à +5 sur une ligne de 100 mm. Le centre de la ligne (indiqué par 0) indique que le chocolat et la musique sont appréciés autant qu’au départ. Un score négatif indique qu’ils ont été moins appréciés par rapport au départ, tandis qu’un score positif indique qu’ils ont été plus agréables.
analyses statistiques
Selon notre calcul de puissance, à une puissance de 80 % et un alpha ajusté de Bonferroni <0,008, une taille d'échantillon de n = 45 donnera un ES cible de d = 0,5 comme différence minimale d'intérêt pour l'une des 6 comparaisons. Le calcul de pleine puissance pour l'étude est présenté en annexe pp3.
L’effet du THC a été déterminé en comparant les scores des résultats de la visite de référence avec ceux après l’administration de THC seul (0: 1) à l’aide de tests t appariés. Pour l’analyse principale, nous avons utilisé des modèles mixtes linéaires pour évaluer l’effet de la variation du rapport CBD:THC sur le rappel différé sur le HVLT-R. Les quatre ratios CBD:THC (0:1, 1:1, 2:1, 3:1) ont été inclus comme effet fixe, avec le participant comme effet aléatoire pour tenir compte de la dépendance entre les mesures répétées. Les 6 contrastes étaient intéressants (0:1 vs 1:1, 0:1 vs 2:1, 0:1 vs 3:1, 1:1 vs 2:1, 1:1 vs 3:1, 2:1 vs 3:1) et alpha a été fixé en fonction des résultats de notre calcul de puissance à p < 0,008 avec l'espoir que des effets modulateurs du CBD pourraient apparaître dans l'une de ces comparaisons. La même analyse a été utilisée pour les résultats pharmacocinétiques, cognitifs, psychologiques, agréables et physiologiques secondaires. Pour tenir compte de tout effet de commande potentiel, des analyses de sensibilité ont été menées en ajoutant la visite dans le modèle en tant qu'effet fixe.
Pour la pharmacocinétique, les scores VAS et les résultats physiologiques, les effets maximaux (0 min pour les résultats pharmacocinétiques et physiologiques) et l’aire sous la courbe (AUC) ont été étudiés. Pour les analyses AUC, les valeurs ont été corrigées de base avant d’utiliser la méthode spline en utilisant le package bayestestR (version 0.7.5.1) [26]. Les différences potentielles dans les scores VAS pour « se sentir paranoïaque » entre les points de temps « post-cognition » et « post-marche » ont été évaluées à l’aide de tests t appariés pour évaluer l’effet de la marche sur la paranoïa.
Les relations entre le temps d’inhalation et la toux avec le pic plasmatique de THC et de CBD, en plus de leurs ASC respectives, ont été évaluées à l’aide des coefficients de corrélation de Pearson.
Nous avons en outre classé les réactions de type psychotique cliniquement significatives comme des augmentations des scores PANSS par rapport au départ de ≥ 3 points, comme dans les études précédentes en raison des effets de plancher [27, 28]. De même, nous avons classé toute augmentation du score SSPS par rapport au départ. La différence de fréquence de ces réactions entre les ratios CBD:THC a été analysée à l’aide du test Chi-carré de Pearson.
Des équations de chaîne d’imputation multiples (MICE) ont été utilisées pour imputer les valeurs manquantes dans les résultats pharmacocinétiques, cognitifs, agréables et physiologiques à l’aide du package souris (version 3.13.0) [29]suite à l’absence de détection d’écart par rapport au manque complètement aléatoire (MCAR) basé sur le test MCAR de Little.
Toutes les analyses ont été effectuées à l’aide de R version 3.5.3. lme4 (version 1.1-26) [30] a été utilisé pour ajuster les modèles linéaires à effets mixtes et les contrastes estimés de la moyenne marginale (EMM) ont été calculés à l’aide du package emmeans (version 1.5.2-1) [31].
